Otimizando a Terapia Nutricional da UTI à Reabilitação Pós-Alta
A massa muscular esquelética é determinada pelo equilíbrio entre síntese e degradação de proteínas. Além disso, o músculo esquelético pode estar aumentado (músculo hipertrófico) quando a alteração nesse equilíbrio favorece a síntese de proteínas. Por outro lado, a perda de massa muscular esquelética (músculo atrófico), ocorre quando a degradação excede a síntese proteica. Essa perda de massa muscular é uma complicação grave causada por ampla variedade de doenças agudas, como ocorre, por exemplo após a internação prolongada em unidade de terapia intensiva (UTI) e/ou condições crônicas, como envelhecimento, desuso, distrofias musculares, insuficiência cardíaca, doença renal crônica, sepse, câncer e muitas outras patologias que impactam negativamente na qualidade de vida.1
A perda do músculo esquelético é um problema quase universal em pacientes sobreviventes de UTI e está associada à morbidade significativa em curto e longo prazo, em geral pela ocorrência de fraqueza muscular e pelo tempo prolongado de suporte ventilatório mecânico. Esse distúrbio é conhecido como fraqueza adquirida na UTI, que é caracterizado por miopatia difusa acompanhada por atrofia, infiltração gordurosa e fibrose das fibras musculares, o que costuma ser mais prevalente em pacientes após 7 dias em ventilação mecânica. Além disso, está intrinsicamente relacionada com a disfunção dos nervos periféricos devido ao edema endoneural e à hipoperfusão periférica consequente à hipóxia microvascular do paciente no estado crítico.2
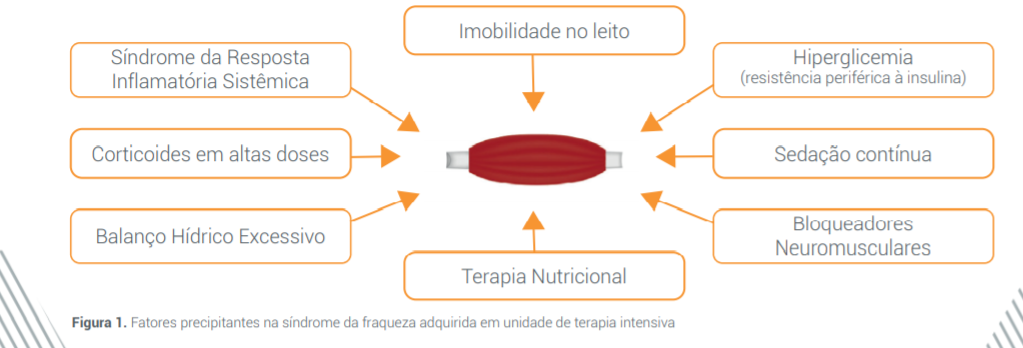
Múltiplos fatores podem desencadear a síndrome da fraqueza adquirida na UTI: intensidade da síndrome de resposta inflamatória sistêmica (SRIS), imobilidade no leito (desuso), hiperglicemia com resistência periférica à insulina, uso de corticoides em altas doses, uso de sedativos e bloqueadores neuromusculares, balanço hídrico excessivo e terapia nutricional (TN) inadequada, conforme mostrado na figura 1.
Em relação à TN inadequada, pode-se citar a gastroparesia, a intolerância do trato gastrintestinal e os procedimentos realizados na UTI como principais fatores limitantes de um suporte nutricional efetivo no doente crítico. O retardo no esvaziamento gástrico ocorre frequentemente e está associado com a intolerância à nutrição enteral (NE), com consequentes alterações na absorção de nutrientes, podendo estar comprometida por atrofia de vilosidades da mucosa, edema local e perfusão esplâncnica reduzida na vigência de uso de vasopressores.3
Outro fator que limita a otimização da terapia nutricional no doente crítico em síndrome do desconforto respiratório agudo (SDRA) é a interrupção da infusão da NE durante a posição prona, amplamente utilizada como estratégia ventilatória para recrutamento de alvéolos na SDRA grave. Recentes estudos demonstraram segurança, tolerabilidade e eficácia da administração da NE em posição prona, desde que haja protocolos institucionais de gerenciamento de risco e monitorização da TN em UTI.5,6
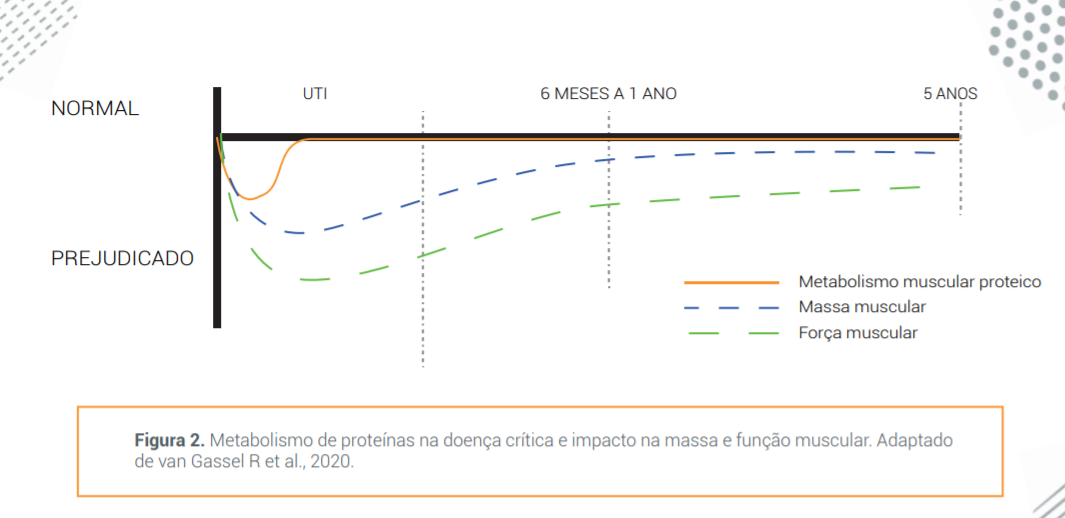
Já as alterações na composição corporal com perda de quantidade e qualidade da massa muscular em doentes críticos, podem ser observadas a partir da primeira semana de internação. Puthucheary et al. demonstraram uma redução de 17,5% na área transversal do músculo reto femoral em pacientes críticos após 10 dias de ventilação mecânica. Além disso, a perda muscular foi maior naqueles com disfunções orgânicas múltiplas e aumentou o tempo de permanência na UTI.7 Herridge et al. avaliaram que as consequências da disfunção muscular em UTI após internação prolongada por SDRA não só ocorrem em curto prazo, mas são observadas redução da capacidade funcional e diminuição na qualidade de vida que permanecem mesmo após 5 anos do evento agudo. 8,9
Sendo assim, pode-se citar que a massa e a função muscular durante e após a internação em UTI (figura 2) são afetadas em três fases distintas:10
- - catabólica aguda: o catabolismo rápido das proteínas musculares devido à resistência periférica à insulina dependente da intensidade da SRIS, pode causar perda intensa de massa e função muscular. Esse processo ocorre ainda durante a internação na UTI;
- - recuperação precoce: o equilíbrio de proteínas é restaurado. Em seguida, há alguma recuperação da massa e, em menor grau, da função muscular. Isso ocorre após alta da UTI e se mantém por até 1 ano;
- - recuperação persistente: a recuperação da massa e função muscular ficam estagnadas e o retorno da função muscular é persistentemente menor do que antes da admissão na UTI. Pode ocorrer até 5 anos após a alta da UTI.
Dessa maneira, faz-se necessário criar programas de intervenção interdisciplinares envolvendo o binômio formado por reabilitação motora e estratégias nutricionais com adequada oferta proteica com aminoácidos específicos sinalizadores de sinalizadores de síntese proteica em taxas adequadas. Esses fatores são importantes na tentativa de amenizar o desequilíbrio entre a quebra e a síntese de proteínas nos pacientes que sobrevivem à UTI. Além disso, sobreviver à UTI é só o início de uma longa jornada que se estende para a fase de reabilitação e intervenção com monitoramento nutricional, cognitivo e comportamental. 11,12
Doença Crítica e Metabolismo Muscular
A perda rápida de músculo esquelético em doenças críticas decorre da consequência de um estado catabólico agudo e prolongado, em que a quebra de proteínas musculares excede a taxa de síntese de proteínas (balanço nitrogenado negativo). Durante doenças críticas, a taxa de catabolismo proteico muscular aumenta acentuadamente, o que parece ser o principal fator do estado hipercatabólico e não uma diminuição na síntese de proteínas, especialmente influenciada pelos altos níveis de citocinas inflamatórias como IL-1, IL-6 e TNF-α, que inicialmente ativam as vias sinalizadoras catabólicas musculares.10
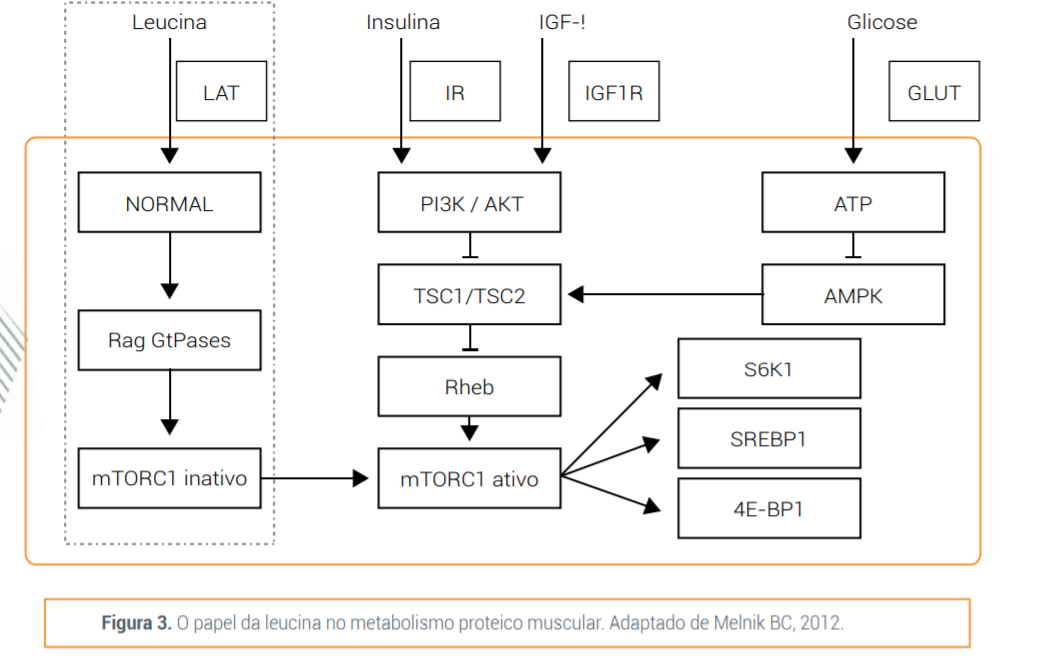
Nesse contexto, vale lembrar que a via central para a sinalização de uma síntese muscular efetiva está na ativação da proteína mTOR (mammalian target of rapamycin) e na regulação do equilíbrio entre a síntese e degradação proteica e, portanto, é importante para o controle do metabolismo muscular esquelético. A mTOR é o regulador celular citoplasmático principal para garantir o tamanho das células musculares, a integração da sinalização de nutrientes (por exemplo, aminoácidos), a regulação por fatores de crescimento (por exemplo, insulina e fator de crescimento semelhante à insulina tipo 1 IGF-1) e o controle de status de energia muscular (ATP) e por modulação da via AMPK. 13
Os nutrientes se tornam essenciais no processo de ativação da mTOR, pois alguns aminoácidos específicos são necessários e suficientes para essa sinalização inicial da síntese proteica. A mTOR existe como dois complexos proteicos: o complexo mTOR1 e 2 (mTORC1 e mTORC2). O complexo mTORC1 é ativado por aminoácidos e considerado o regulador principal da síntese de proteínas. Após sua ativação, mTORC1 leva a fosforilação e ativação de duas vias de sinalização paralelas envolvidas no controle da transcrição de fatores da síntese proteica: a fosforilação da S6 quinase 1 (S6K1) leva à ativação da proteína ribossômica S6, enquanto a fosforilação do fator de iniciação eucariótico 4E (eIF4E) - proteína de ligação (4EBP1) libera sua inibição da tradução do fator de iniciação eIF-4E, permitindo o início da transcrição e síntese de novas proteínas musculares.13
Fatores de crescimento (insulina, IGF-1) estimulam o mTORC1 por um mecanismo bem definido, envolvendo a fosforilação de uma proteína quinase - AKT, permitindo que o pequeno homólogo da GTPase chamado Ras (via Rag) se ligue ao mTORC1 e promova sua atividade quinase. Contudo, fatores de crescimento não podem ativar eficientemente o mTORC1 sem a presença de aminoácidos específicos. 15 Assim, na presença desses aminoácidos ocorre a ativação do mTORC1 através de um mecanismo independente dos fatores de crescimento, modulando o metabolismo das proteínas através desse estímulo, que deve receber considerável atenção como um tratamento potencial nas condições de perda de massa muscular na UTI.
Whey protein e leucina
Diante desse contexto, a proteína do soro do leite (whey protein) ganha grande destaque pela sua composição nitrogenada formada por diferentes proporções de ß-lactoglobulinas, α-lactoalbuminas, lactoferrina e imunoglobulinas. Além disso, contém todos os aminoácidos essenciais para a síntese proteica muscular em concentrações mais elevadas do que outras fontes proteicas, como por exemplo as proteínas vegetais. Além disso, é abundante em leucina (14%) e em outros aminoácidos de cadeia ramificada (26%). 16
O whey protein também é rico em aminoácidos contendo enxofre, como a cisteína e a metionina, que melhoram a função imunológica através da conversão intracelular em glutationa, um potente antioxidante intracelular e, por essa razão, pode favorecer a atividade da glutationa peroxidase, derivado do selênio e cisteína, sendo um antioxidante endógeno que converte peróxidos lipídicos em hidroxiácidos menos prejudiciais, assim controlando o estresse oxidativo celular.16,17 Outro componente importante é a lactoferrina, presente no whey protein (1%), que tem propriedades antibacterianas e antivirais, com ações na prevenção do crescimento de organismos patogênicos intestinais, na estimulação do sistema imunológico e na regulação no metabolismo do ferro.18
Com relação à qualidade proteica, comparando com outras fontes nitrogenadas, o whey protein tem uma maior concentração de leucina e foi demonstrado ter um pico mais rápido e mais efetivo na disponibilidade muscular pós-prandial do que a caseína ou a proteína de soja, embora todas contenham os aminoácidos necessários para estimular a síntese de proteínas musculares. 1,17 Além disso, o whey protein mostrou preservar a massa muscular durante a perda de peso intencional em adultos obesos, pois peptídeos bioativos gerados a partir da sua hidrólise têm estimulado a liberação de vários hormônios intestinais, incluindo colecistocinina, peptídeo YY, polipeptídeo insulinotrópico dependente de glicose (GIP-1) e peptídeo semelhante ao glucagon (GLP-1) que potencializam a secreção de insulina. Isso pode explicar também a melhor resposta à insulina após a ingestão do whey protein em comparação à caseína ou proteína da soja.
Em doentes críticos, o whey protein facilita a digestão e absorção dos aminoácidos, pois diminui a precipitação e a coagulação de proteínas na cavidade gástrica. Como resultado, o tempo total de esvaziamento gástrico se reduz e a disponibilidade muscular pós-prandial tem concentrações mais elevadas em comparação às outras fontes proteicas. Por isso, são consideradas “proteínas rápidas”, pois atingem o jejuno rapidamente, porém, a hidrólise dos peptídeos é mais lenta do que a da caseína, permitindo maior absorção ao longo de todo o comprimento do intestino delgado proximal. 17
Todavia, o ponto mais importante na administração do whey protein para recuperação da massa muscular está na quantidade de leucina, que é seu principal aminoácido essencial e, cujos carbonos derivados da sua transaminação, são a principal fonte de energia do músculo esquelético. Além disso, a leucina estimula a síntese proteica, pela via mTOR e inibe a degradação do músculo esquelético.1 Recentes estudos demonstram que a leucina diretamente induz o acúmulo de proteína miofibrilar nas células do músculo esquelético e que isso envolve um mecanismo pré-traducional, parcialmente independente da atividade do mTOR.13
A leucina modula a síntese e a quebra de proteínas através de dois mecanismos distintos, convergindo na via da 3-fosfatidilinositol quinase (via PI3K-AKT-mTOR). A liberação de insulina estimulada pela leucina, ativa a AKT através do receptor de insulina e de seu substrato (IRS). Contudo, a leucina também pode estimular o mTORC1 através de um mecanismo independente da insulina que envolve a via GTPase relacionada à Ras (Rag).A ativação do mTORC1 estimula a síntese de proteínas através da fosforilação de S6K1 e 4E-BP1 e consequente transcrição de sinalizadores da síntese proteica. A inflamação e estresse oxidativo, comuns durante a perda de massa muscular no doente crítico catabólico, atenuam a ativação de mTORC1, enquanto a ativação crônica de mTORC1 leva à sinalização prejudicada da insulina, devido à resistência periférica aumentada, através de um loop de feedback negativo da S6K1 e do IRS, podendo ser controlada com uma oferta adequada de leucina, conforme mostrado na figura 3.
Conclusão
Concluindo, o whey protein é a fonte proteica ideal no doente crítico e na fase de recuperação muscular pós-alta da UTI, pois tem boa digestibilidade e tolerância no trato gastrintestinal, além da efetiva cinética de absorção, com rápido esvaziamento gástrico e controle do estresse oxidativo gerado pela doença crítica. Além disso, sua composição em leucina fornece proteção contra a perda de massa muscular durante os estágios iniciais da doença crítica e também reduz a expressão de genes de regulação da perda muscular em longo prazo, fazendo com que a fase de recuperação pós-alta da UTI seja mais efetiva e encurtada com melhor modulação dos mecanismos sinalizadores da síntese proteica no músculo esquelético.

A massa muscular esquelética é determinada pelo equilíbrio entre síntese e degradação de proteínas. Além disso, o músculo esquelético pode estar aumentado (músculo hipertrófico) quando a alteração nesse equilíbrio favorece a síntese de proteínas. Por outro lado, a perda de massa muscular esquelética (músculo atrófico), ocorre quando a degradação excede a síntese proteica. Essa perda de massa muscular é uma complicação grave causada por ampla variedade de doenças agudas, como ocorre, por exemplo após a internação prolongada em unidade de terapia intensiva (UTI) e/ou condições crônicas, como envelhecimento, desuso, distrofias musculares, insuficiência cardíaca, doença renal crônica, sepse, câncer e muitas outras patologias que impactam negativamente na qualidade de vida.¹
A massa muscular esquelética é determinada pelo equilíbrio entre síntese e degradação de proteínas. Além disso, o músculo esquelético pode estar aumentado (músculo hipertrófico) quando a alteração nesse equilíbrio favorece a síntese de proteínas. Por outro lado, a perda de massa muscular esquelética (músculo atrófico), ocorre quando a degradação excede a síntese proteica. Essa perda de massa muscular é uma complicação grave causada por ampla variedade de doenças agudas, como ocorre, por exemplo após a internação prolongada em unidade de terapia intensiva (UTI) e/ou condições crônicas, como envelhecimento, desuso, distrofias musculares, insuficiência cardíaca, doença renal crônica, sepse, câncer e muitas outras patologias que impactam negativamente na qualidade de vida.¹
Faça o Login ou Cadastre-se para ver todos os conteúdos exclusivos