Introdução:
O simpósio foi presidido pelo Prof. Paolo Lionetti e tratou sobre as novas estratégias nutricionais para controlar a Doença de Chron (DC), sendo dividido em duas apresentações. Confira o Highlight das duas partes e ao final do material traremos o vídeo na íntegra e o material escrito pelos palestrantes para que possa aprofundar seus estudos.

O Prof. Rümmele comentou sobre a importância da nutrição enteral para o tratamento da DC e apresentou o resultado do primeiro ensaio clínico randomizado, mostrando a eficácia da nutrição enteral cíclica exclusiva (NEE) para a manutenção da remissão e cicatrização da mucosa.
Iniciou sua apresentação com a história natural da DC¹ que resumidamente mostra o pico de inflamação da mucosa intestinal e de sintomas clínicos por época do diagnóstico, que com o passar do tempo evolui para dano na mucosa, levando à doença descontrolada com potenciais estenoses, abscessos ou fístulas, ocasionando cirurgias.
Comentou que o objetivo da terapia é intervir nesta evolução, bloqueando esse processo e controlando a inflamação. Como sabemos, temos a “janela da oportunidade” para ser usada o mais precocemente e controlar o dano ao intestino e sua disfunção.
Estudo de Jeuring SFG et al.² comprovou o efeito da introdução do biológico, antiTNF, em 1.162 adultos com DC, com diminuição das taxas de hospitalização e de ressecções cirúrgicas, nos períodos de 1991 a 1998 (época sem biológicos); de 1999 a 2005 (quando iniciou uso de antiTNF) e de 2006 a 2011(fase consagrada do uso do antiTNF).

Com isso, o Prof. Rümmele concluiu que realmente os algoritmos de tratamentos com o uso de antiTNF são eficazes.
O novo algoritmo de tratamento da DC pediátrica do Guideline ECCO/ ESPGHAN³ mostra o antiTNF como centro do tratamento na maioria das situações e de uso precoce em pacientes com risco potencial de pior evolução, como a doença perianal e com falha da terapia de indução com corticoide ou nutrição enteral exclusiva (NEE).

A coorte de Lemaitre5 com 189.289 pacientes com DII, comparou ao longo do tempo,o risco cumulativo de linfoma em 4 grupos: expostos à terapia combinada antiTNF + tiopurina, expostos à monoterapia com antiTNF, expostos somente a tiopurinas e os que não receberam nem tiopurinas nem antiTNF. No resultado foi verificado um risco maior no grupo com terapia combinada e pouco aumentado nos grupos antiTNF e tiopurina em monoterapia.
Citou o guideline ECCO/ESPGHAN 2020, no qual foram fixados os objetivos do tratamento da DC pediátrica:³
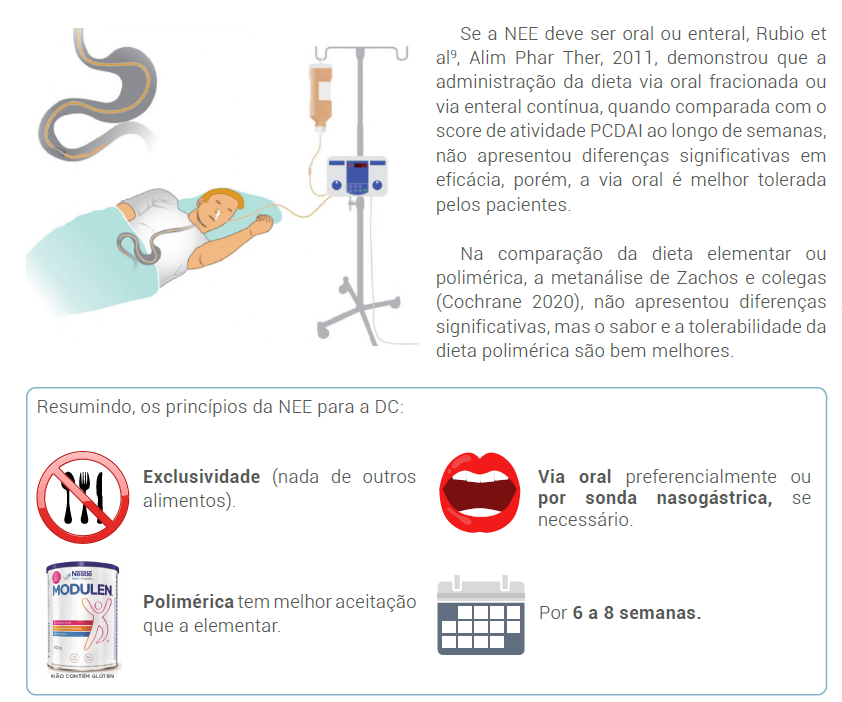
São conhecidos de longo tempo os excelentes resultados da nutrição enteral exclusiva (NEE), recomendada nos guidelines ECCO/ESPGHAN 2014, como terapia de primeira linha na indução de remissão de crianças com DC luminal ativa - 96% de concordância e, que a nutrição enteral parcial (NEP) não é recomendada para indução de remissão - 100% de concordância.
O Consenso ECCO/ESPGHAN de 20203 – JCC, cita que a terapia de indução para DC luminal é a NEE.
Por que esta recomendação?
Estudos demonstraram a cicatrização total da mucosa em 2 meses após o uso da NEE e azatioprina6, além de ensaio clínico francês Modulen® RTC7, comparando a NEE com Modulen® e com esteroide como terapia de indução na DC. Modulen® demonstrou ser mais eficaz que o corticoide, com queda nos índices de atividade clínica de 0,1±0,4 e 1,8±2,2, p< 0,05, respectivamente e, de atividade endoscópica, cicatrização da mucosa, CDEIS de 8/9 (89%) e 1/6 (17%), p < 0,05, respectivamente.
Outro estudo de Borrelli8, demonstrou melhor escore histológico com Modulen® NEE do que com corticoide, tanto em íleo como no cólon.
Considerando a dificuldade em seguir a NEE pela impossibilidade de consumir qualquer outro alimento, “como fazer nossos pacientes aceitarem a NEE?”
Temos vários elementos para convencê-los e um dos mais importantes é a melhora da curva de peso e estatura em pacientes desnutridos ou com atraso de crescimento. Mostrou o gráfico de um paciente seu, que quando usou esteroide, houve aumento somente de peso e quando este mesmo paciente apresentou nova ativação da doença e recebeu a NEE, evoluiu com bom aumento de peso e também de estatura.
Outro argumento é o rápido efeito na diminuição dos sintomas clínicos e queda da proteína C reativa (PCR) em 3 a 5 dias de NEE.
Mostrou o estudo de Johson T et al Gut 2006, comparando a NEP com NEE com o índice de atividade da DC pediátrica (PCDAI) e subscore de diarreia significantemente menores (p= 0,005 e p=0,04, respectivamente) nos pacientes com NEE, portanto, a NEE é a única opção efetiva.
Na DC luminal, independentemente da localização (qualquer parte do intestino delgado ou grosso), “Qual é o efeito da NEE no mecanismo de inflamação da mucosa na DII?” Estudos demonstram que no lúmen intestinal existem diversos agentes da microbiota e que podem ser modificados conforme as substâncias que são ingeridas na dieta e quando ocorre a disbiose, havendo a estimulação de vários mecanismos de resposta inflamatória do sistema imune intestinal. Se conseguirmos eliminar a disbiose retirando da dieta nutrientes que levem à inflamação, teremos menor impacto no sistema imune e maior diminuição da cascata inflamatória.
Sabemos ao longo dos anos de estudos, que estes pacientes com DII apresentam disbiose.
Estudo de Pigneur et al. JCC, 2019, mostra significantes diferenças da microbiota dominante em grupos de pacientes antes e depois de tratados com a NEE com Modulen® e grupo tratado com corticoide (p< 0,049). Nos pacientes com a NEE com Modulen® verificou-se a diminuição nos firmicutes, aumento de actinobactérias e de bacteroides.
Olhando para o futuro e traduzindo todos estes dados citados: ”o que esperamos da nutrição enteral para esses pacientes com a DC?”
Mostrou o desenho de seu estudo clínico, chamado CD HOPE, para responder a pergunta:
“Existe espaço para a NEE por 2 a 8 semanas mantendo a remissão dos pacientes em longo prazo, como principal nutrição?”
Desenho do estudo: pacientes que responderam à NEE por 6 semanas foram randomizados para retorno à dieta normal com suplementação de Modulen® (por boca) com 25% da necessidade nutricional diária ou para grupo que recebeu a NEE em ciclos de 2 semanas a 6 semanas.
Follow up: visitas a cada 6 semanas, até completar 12 meses, comparando o índice PCDAI e a calprotectina. Verificou-se que a taxa de remissão e de recaídas são diferentes.
Este é um trabalho ainda não publicado, que foi apresentado pelo Dr. Pigneur na sessão de apresentação oral deste congresso.
Para os curiosos, o prof. Rümmele mostrou o gráfico do resultado deste estudo, onde a taxa de remissão do grupo que recebeu a NEE cíclica foi muito maior, significante estatisticamente (p =0,0039)
em comparação com o grupo que recebeu a dieta com suplementação ao longo do tempo.
Resumindo, concluiu que a NEE:
- É altamente eficaz;
- Tem excelente perfil de segurança;
- Tem boa aceitação (se mostrar o crescimento e a rápida melhora);
- Tem aceitação oral melhor que por sonda nasogástrica;
- Deveria ser abordagem top down pela cicatrização da mucosa demonstrada;
- Utilizada com outra abordagem nutricional em longo prazo.
Ou seja, a introdução de um novo conceito da dieta exclusiva, a terapia nutricional aparece pela 1ª vez como alternativa em longo prazo ao tratamento medicamentoso, para os respondedores à NEE.

O Prof. Levine seguiu discutindo os insights e estratégias recentes no manejo dietético da DC com Dieta de Exclusão da Doença de Crohn (DEDC) combinada com a NEP para indução e manutenção da remissão em pacientes com DC ativa leve à moderada, como também em condições mais graves.
Iniciou sua apresentação com a definição da estratégia: plano geral para alcançar os objetivos em longo prazo sob a condição de incerteza. Nas DIIs só temos como estratégia de tratamento step up acelerado ou top down, com os medicamentos disponíveis.
Os objetivos da terapia na DC em curto prazo, no paciente com a doença ativa são a remissão clínica, a diminuição da inflamação e a manutenção da remissão e do crescimento nas crianças. Em longo prazo são: cicatrização da mucosa, prevenir complicações e redução de cirurgias, para que a terapia não traga nenhum mal ao paciente, reduzindo ou até evitando a imunossupressão e eventos adversos sérios, como o risco de câncer.
Mas a pergunta é: quais alimentos devem ser excluídos?
Três estudos entre 2020 e 2021 demonstram que emulsificantes, carragena e gomas têm efeito tóxico no microbioma, levando à inflamação, mas que a lecitina de soja não tem efeito sobre a microbiota ou o efeito tóxico seria somente em altas doses.10-13
Estudo de relevância do próprio Levine¹¹, comparou a evolução dos pacientes DEDC X NEE para tratamento da DC, sem diferença na resposta ou remissão clínica até a semana 6, mas a DEDC teve melhores resultados que a NEE na remissão sustentada (p 0,01) na semana 12, quando já havia a introdução alimentar nos pacientes em NEE.

Confira o Highlight elaborado pela Dra Adriana Catapani que tratou sobre as novas estratégias nutricionais para controlar a Doença de Chron (DC), sendo dividido em duas apresentações.

Em outro estudo (Segal Boneth et al. Clin Gastro Hepatol 2020) comparando a DEDC e a NEE, a porcentagem de pacientes com resposta e remissão clínica na semana 3, além da redução de PCR e calprotectina, ocorreram rapidamente nos 2 grupos. Usamos esta rápida resposta na melhora da inflamação para identificar os pacientes fenótipo bons respondedores à dieta de exclusão. Portanto, não temos marcadores sanguíneos ou fecais para saber se o paciente é um bom respondedor à dieta, mas sim, sua evolução até a semana 6 de dieta de exclusão, para saber selecioná-los.

Nova estratégia de dieta com DEDC + NEP
Pacientes com DC não complicada, atividade leve à moderada, que estejam dispostos a aderir à dieta,começam com DEDC + NEP e observa-se a resposta à dieta com remissão clínica e sem sinais deinflamação. Então, são divididas em 3 diferentes estratégias:
1ª Estratégia sem droga: dieta DEDC em monoterapia (sem medicação) por 6 semanas e depois período de manutenção, sem droga também, por 1 ano (nunca tenha usado nenhuma medicação prévia).
2ª Estratégia de redução de droga, combinação de terapia dietética e medicação:mais comumente utilizada. No 1º ano remove o fator ambiental com a dieta, que contribui para inflamação. Utilizada naqueles pacientes que não respondem tão bem aos medicamentos ou com perda de resposta, usam a dieta DEDC para resgate do uso do tratamento medicamentoso. Se após 1 ano obtiveram remissão clínica e cicatrização da mucosa, ficam somente com a dieta, com desescalonamento da droga e sua redução, até que a dieta seja a monoterapia (estratégia de redução de droga).
3ª Estratégia para os pacientes que estavam somente com drogas: não conseguiram a terapia dietética, afinal, a terapia dietética não é para todos, mas tiveram reativação da doença, por perda de resposta ao medicamento. Usam a DEDC como terapia de resgate para o biológico.
Agora detalhando cada uma:
1ª DEDC + NEP monoterapia
- População: DC não complicada em atividade leve à moderada, sem envolvimento articular.
- Vantagem: sem medicações.
- Desvantagem: dependência da dieta.
- Decisão feita na semana 6 ou 12 em dieta responsiva e paciente experiente com a dieta.
- Motivar o paciente mostrando que a parte mais difícil da dieta já foi superada!
- Se ocorrer recorrência da inflamação, regresse para a fase 1 da dieta (sucesso na maioria dos pacientes).
- Se a inflamação não controlar, adicionar os medicamentos.
2ª Dieta e droga:
- População: DC não grave
- Vantagens: comboterapia direcionada para ambos: microbiota e inflamação. Estratégia de desescalonamento possível, se não tiver complicações ou artrites.
- Desvantagem: uso de drogas (MTX ou AntiTNF). Para doenças não complicadas começam com MTX, pois pode ser descontinuado mais facilmente que o antiTNF.
Decisão de escalonamento em 1 ano se:
- 1. Houver cicatrização completa da mucosa.
- 2. Se o paciente estiver disposto a manter a dieta
- 3. Se as estratégias com antiTNF falharem.
3. Dieta como terapia de resgate
- População: DC refratária ou perda de resposta,antes de mudar para outro tratamento.
- Vantagens: comboterapia visando ambos: microbiota e inflamação.
Pode tratar doença refratária com cicatrização demucosa. Permite manter a terapia medicamentosa. Pode ser a única terapia que funcione se o tipo dealimentação continuar impulsionando atividade à doença. Desvantagem: requer a colaboração do paciente.
Nos pacientes com doença leve à moderada,mas com alguma complicação (fístulas,doença perianal) que vão ter que usar o antiTNF,principalmente se desnutridos, podemos usara dieta de exclusão como ponte para a terapia. DEDC + NEP na fase 1 induz a remissão e depoisdecidir se mantém uma terapia combinada de droga e dieta ou terapia medicamentosa sozinha.Mas se o paciente com antiTNF operar sua fístula, por exemplo, pode usar uma outra estratégia deterapia dietética, mas não a DEDC fase 1, mas sim manter na fase 2 /3 com algumas restrições dealimentos, não para induzir a remissão como na fase 1, mas para diminuir a exposição aos alimentosinflamatórios, com uma dieta personalizada para este paciente.
O Prof. Levine concluiu:
- - A DEDC é efetiva para a remissão da DC em crianças e adultos.
Capaz de induzir e manter a remissão como monoterapia em mais de 50% dos pacientes adultos (mais difícil manter em crianças).
- - Associada com declínio da calprotectina, PCR e cicatrização da mucosa em 6 meses.
- - A Terapia dietética seria um biomarcador para a detecção dos pacientes com doença responsivaà dieta, conforme evolução clínica (Dietary Responsive Disease, DRD).
- - Momento ideal de detectar esse fenótipo é o diagnóstico, antes da introdução de drogas, pois senão não se saberá o que levou à remissão.
- - DEDC fase 1 para identificar a doença responsiva à dieta e indução da remissão.
- - DEDC fase 2 ou 3 para redução na estratégia de exposição aos alimentos inflamatórios para os pacientes com DC complicada ou que não responderam bem ao uso de biológicos.
- - Outras dietas poderão levar à redução na exposição, mas precisam ser rigorosamente validadas.
confiraaqui o material desenvolvido pelos palestrantes para acessar a transmissão na íntegra clique aqui.
Referências bibliográficas
1.Pariente B, et al. Development of the Crohn’s disease digestive damage score, the Lémann score. InflammBowel Dis 2011;17:1415–222. 2. Jeuring SFG, et al. Improvements in the Long-Term Outcome of Crohn’s DiseaseOver the Past Two Decades and the Relation to Changes in Medical Management: Results from the Population-BasedIBDSL Cohort. Am J Gastroenterol. 2017;112(2):325-336. 3. ERheenen P et al. The Medical Management of PaediatricCrohn’s Disease: an ECCO-ESPGHAN Guideline Update. ECCO/ESPGHAN CD Guidelines. J Crohns Colitis,. 2020. 4. Hyams J et al. Long-term outcome of maintenance infliximab therapy in children with Crohn’s disease. Inflamm BowelDis. 2009;15(6):816-22. 5. Lemaitre M et al. Association Between Use of Thiopurines or Tumor Necrosis Factor AntagonistsAlone or in Combination and Risk of Lymphoma in Patients With Inflammatory Bowel Disease. JAMA. 2017. 6.Heuschkel Rb et al. JPGN 2007;45(1). 7. H Pigneur et al. 2021, Abstract at WCPGHAN 2021 8. Borrelli O et al. Polymericdiet alone versus corticosteroids in the treatment of active pediatric Crohn’s disease: a randomized controlled open-labeltrial. Clin Gastroenterol Hepatol. 2006; 4(6):744-53. 9. Rubio et al. The efficacy of exclusive nutrition therapy in paediatricCrohn’s disease, comparing fractionated oral vs. continuous enteral feeding. Alim Pharm Ther, 2011; 33: 1332–1339. 10.Levine A et al. Crohn’s Disease Exclusion Diet Plus Partial Enteral Nutrition Induces Sustained Remission in a RandomizedControlled Trial. Gastroenterology. 2019;157(2):440-450. 11. Logan M et al. The reduction of faecal calprotectin duringexclusive enteral nutrition is lost rapidly after food re-introduction. AP&T 2019. 12. Naimi S et al. Direct impact of commonlyused dietary emulsifiers on human gut microbiota. Microbiome 2021;22;9(1):66. 13. Sandall A et al. EmulsifiersImpa 13. Sandall A et al. Emulsifiers Impact Colonic Length in Mice and Emulsifier Restriction is Feasible in People withCrohn’s Disease. Nutrients 2020;12(9), 2827.
Confira o Highlight elaborado pela Dra Adriana Catapani que tratou sobre as novas estratégias nutricionais para controlar a Doença de Chron (DC), sendo dividido em duas apresentações.
Faça o Login ou Cadastre-se para ver todos os conteúdos exclusivos