Confira o Highlight comentado sobre o Pré Congresso de Nutrição pela Nutricionista Izabel Lamounier - Mestre em Nutrição Experimental pela USP, Especialista em Nutrição Enteral e Parenteral (BRASPEN), Nutricionista ABCD e Membro GEDIIB.
Highlights comentado sobre o Pré Congresso de Nutrição
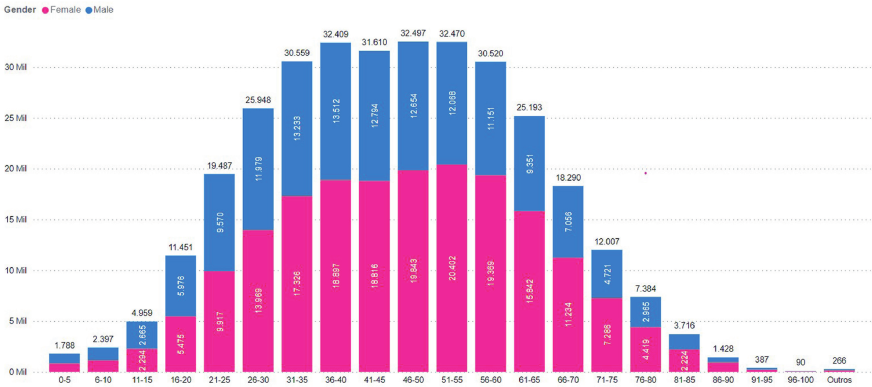
Houve abordagem do estudo de Quaresma et al., a respeito da epidemiologia da DII no Brasil, a incidên- cia de DC está diminuindo enquanto a de RC está aumentando, levando à estabilização da incidência de DII de 2012 a 2020 no Brasil. A prevalência de DII tem aumentado com 0,1% dos brasileiros vivendo com DII em 2020. Um total de 212.026 pacientes com DII foi identificado (RC: n=119.700; DC: n=71.321; DII indeterminada: n=21.005). A razão RC:DC foi de 1,7:1. Houve predominância do sexo feminino (n=123.992, 58,5%) em relação ao sexo masculino (n=86.902, 41%) e 0,5% tinham sexo indetermina- do (n=1.132 pacientes). A idade na data do índice foi mais comum entre 36 e 55 anos (figura 1).1.
Neste contexto, a pergunta que fazemos é: qual é o papel da nutrição na DII?2,3
- Recuperar ou manter o estado nutricional para garantir a melhor resposta aos medicamentos e maior tempo de remissão;
- Direcionar os gatilhos ambientais inflamatórios e a progressão da DII;
- Reduzir os sintomas, como diarreia, constipação, náuseas e dor;
- Induzir ou manter a remissão quando houver falha do medicamento;
- Melhorar a qualidade de vida.
Na revisão sistemática de Day et al., a respeito de restringir alimentos, comportamento alimentar restritivo e associação com qualidade de vida em adultos com doença inflamatória intestinal, foi identificada uma alta prevalência de evitar alimentos (28–89%) e comportamentos alimentares restritivos (41–93%). Os fatores associados a esses comportamentos incluíram diagnóstico de DC, em fase de doença ativa, sexo feminino, desinformação alimentar e medo de sintomas intestinais adversos. A dieta e a qualidade de vida permanecem amplamente inexploradas na DII, além de dois estudos recentes que demonstraram comprometimento da qualida de de vida relacionada à alimentação na DII. Os autores concluíram que existe uma alta prevalência de autorrelato de evitar alimentos e comportamento dietético restritivo em pessoas com DII. O impacto psicossocial do comportamento alimentar relacionado à DII é pouco conhecido.4
De acordo com o exposto na Diretriz ESPEN, o padrão alimentar restritivo na DII que está diretamente relacionado com o estado nutricional, corrobora para muitos fatores, tais como: 2

Ainda, outras informações importantes podem ser extraídas:2
- Maior consumo de fibras (mediana de 24g/dia) associou-se a menor risco de DC;
- Maior consumo de vegetais e frutas associou-se a menor risco de RC;
- Maior ingestão de fibras associou-se a menor atividade endoscópica;
- Substratos para produção de AGCC (butirato, acetato e lactato) melhoram a integridade intestinal;
- Fibras solúveis específicas (banana e brócolis) reduzem translocação bacteriana.
Em outro estudo sobre crenças e comportamento de Zallot et al., um total de 244 pacientes participaram da pesquisa; 15,6% (n = 38) dos pacientes acreditavam que a dieta poderia iniciar a doença, enquanto 57,8% (n = 141) acreditavam que a alimentação poderia desempenhar um papel na causa da recaída. 40% (107/244) dos pacientes identificaram a alimentação como fator de risco para recaída. 73% dos entrevistados relataram já ter recebido orientação nutricional.5
A maioria dos entrevistados (47,5%, n = 116) relatou que a doença havia alterado o prazer de comer. Apenas 1/4 dos pacientes teve uma dieta normal em caso de recaída. Quase 2 em cada 3 pacientes (66,8%, n= 163) relataram não comer certos alimentos que costumam comer para evitar uma recaída. Crenças dietéticas e comportamento tiveram um impacto em sua vida social para um quinto dos pacientes. A exclusão de alimentos foi associada à recusa de refeições ao ar livre por medo de causar recaída (P = 0,006) e não compartilhar o mesmo cardápio com os outros membros da família que vivem sob o mesmo teto (P = 0,002).5
No que diz respeito ao glúten e DII, este não foi fator de risco para o desenvolvimento de DII mesmo em indivíduos com predisposição genética. Assim sendo, a exclusão empírica não deve ser recomendada com o objetivo de prevenir nem de tratar DII, segundo Lopes et al.6
Tratando-se de lactose não há relação entre o seu consumo e o risco de desenvolvimento de DII. A atividade da doença pode afetar a digestão da lactose em alguns pacientes, em particular aos pacientes com DC com envolvimento do intestino delgado. Segundo Szilagyi et al., há evidências sugestivas de que os laticínios podem ter benefícios na DII, por resultarem em aumento da microbiota intestinal, assim sendo, a restrição total pode ter impacto desfavorável. A maioria das pessoas intolerantes à lactose pode ingerir até 12g/dia de lactose (250 mL de leite) sem apresentar sintomas adversos.7
Segundo Bolte et al., padrões alimentares de longo prazo estão associados a características pró-in- flamatórias e anti-inflamatórias do microbioma intestinal.8
Os autores propõem 3 questionamentos:
1. O que já se sabe sobre este assunto?
- A dieta ocidental e a inflamação intestinal de baixo grau estão implicadas em um número crescente de doenças inflamatórias imunomediadas.
- A quantidade, o conteúdo e o tempo da dieta desempenham um papel importante na formação da composição e função microbiana do intestino.
- Disbiose, mudanças nos metabólitos e translocação de produtos microbianos contribuem para a ativação imune.
- A pesquisa tem se concentrado nas propriedades anti-inflamatórias de compostos isolados, com eficácia limitada.
2. Quais são as novas descobertas?
- As associações dieta-microbioma intestinal são consistentes em pacientes com doença intestinal (doença de Crohn, RC, SII) e na população em geral.
- A maior ingestão de alimentos de origem animal, alimentos processados, álcool e açúcar, corres- ponde a um ambiente microbiano característico da inflamação e está associada a níveis mais elevados de marcadores inflamatórios intestinais.
- Alimentos à base de plantas estão ligados a produtores de ácidos graxos de cadeia curta (AGCC), metabolismo microbiano de polissacarídeos e uma menor abundância de patobiontes.
3. Como isso pode impactar a prática clínica em um futuro próximo?
- A modulação da microbiota intestinal por meio de dietas enriquecidas em vegetais, legumes, grãos, nozes e peixes e uma maior ingestão de vegetais em relação aos alimentos de origem animal, tem o potencial de prevenir processos inflamatórios intestinais no centro de muitas doenças crônicas.
- Padrões dietéticos baseados em alimentos integrais podem aumentar a capacidade anti-inflama- tória dos nutrientes através de efeitos sinérgicos no microbioma intestinal.
- Fontes de PUFAs n-3 (ácidos graxos poli-insaturados ômega-3) e polifenóis podem ser usadas para potencializar a abundância de produtores de AGCC (ácidos graxos de cadeia curta).
- A substituição de proteína animal por proteína vegetal tem potencial para reduzir processos inflamatórios intestinais, visando as vias microbianas envolvidas.
A pesquisa em nutrição tem se concentrado nas últimas décadas mais em padrões de combinação de alimentos do que em alimentos/nutrientes individuais devido aos possíveis efeitos sinérgicos/anta- gonistas dos componentes em um modelo dietético. Vários padrões alimentares têm sido associados a benefícios para a saúde, mas o maior corpo de evidências na literatura é atribuível aos hábitos alimentares tradicionais e ao estilo de vida seguido pelas populações da região do Mediterrâneo . Após o Estudo dos Sete Países, muitos estudos observacionais prospectivos e ensaios em diversas populações reforçaram os efeitos benéficos associados a uma maior adesão à dieta mediterrânea no que diz respeito à prevenção/gestão de doenças não transmissíveis associadas à idade, tais como: doenças cardiovasculares e metabólicas, doenças neurodegenerativas, cancro, depressão, doenças respiratórias e fraturas por fragilidade. Além disso, a dieta mediterrânea é ecologicamente sustentá- vel. Portanto, este patrimônio mundial imaterial constitui uma forma saudável de se alimentar e viver respeitando o meio ambiente. 9
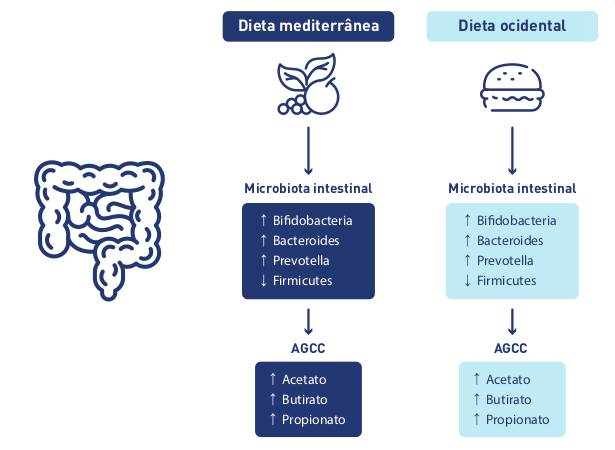
A Dieta Mediterrânea e a dieta ocidental exercem efeitos opostos na composição da microbiota intesti- nal com consequentes modificações na produção de AGCC.9
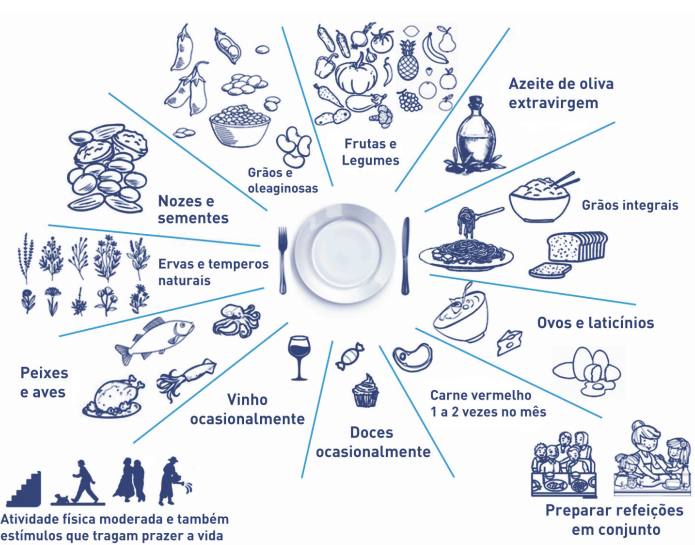
Componentes nutricionais e de estilo de vida da Dieta Mediterrânea, que têm sido associados com maior longevidade e redução da incidência de doenças crônicas não transmissíveis relacionadas à idade.9
O Dietary Guidance From the International Organization for the Study of Inflammatory Bowel Diseases3, quando se refere a tipos de dietas e tratamento para DII, faz os seguintes apontamentos:
- Dieta com carboidratos específicos: poucos estudos mostram benefícios na indução de remissão.
- Dieta com baixo FODMAP: sem efeito na inflamação e pode aumentar a permeabilidade intestinal.
- Dieta sem glúten: pouco benefício nos sintomas gastrointestinais. Sem efeito na inflamação.
- Dieta anti-inflamatória: sem evidências.
- Dieta hipoalergênica: sem evidências na redução da inflamação.
De acordo com Gerasimidis et al., a dieta é um modificador chave do risco de desenvolvimento de doença inflamatória intestinal e potencialmente uma opção de tratamento em pacientes com doença estabelecida. Muitos são os estudos que demonstram benefícios no uso de Nutrição Enteral Exclusiva (NEE) na Doença de Crohn com fórmula polimérica com TGF-β2, e mais evidências estão sendo publica- das apontando desfechos clínicos favoráveis com a Dieta de Exclusão da Doença de Crohn (DEDC) associada ao uso de Nutrição Enteral Parcial com Fórmula Polimérica com TGF-β2 (NEP Modulen®)10, sendo alternativa a NEE em pacientes adultos e pediátricos com doença leve a moderada para indução de remissão (grau B de recomendação com forte consenso 100% de concordância)2 assim como para pacientes que não obtiveram sucesso com a terapia biológica.11 Sinais dietéticos de pesquisas epidemio lógicas e experimentos pré-clínicos em modelos animais precisam de confirmação em ensaios clínicos bem desenhados antes que qualquer recomendação dietética para o manejo de doenças possa ser feita.

Mais de 1/3 dos pacientes adultos com DII apresentam miopenia e pré-sarcopenia, e quase 1/5 apresenta sarcopenia. A miopenia na DII está significativamente associada ao aumento do risco de falha da terapia para DII, complicações pós-operatórias e baixa Densidade Mineral Óssea, com possível associação com aumento do risco de Doença Hepática Gordurosa Não Alcóolica. A terapia nutricio- nal pode desempenhar um papel na reversão da baixa massa muscular, embora ainda não esteja claro se isso ocorre através da reversão da atividade da doença.
Mais estudos em pacientes adultos com DII com foco em sarcopenia/miopenia são necessários com os seguintes desenhos de estudo recomendados:12
- Definições padronizadas baseadas na população para medir a massa muscular esquelética.
- Estudos prospectivos com pacientes com DII estratificados pela classificação de Montreal: atividade da doença, duração da doença e medicação concomitante para observar alterações musculares.
- Estudos sobre a etiologia da sarcopenia, focando especificamente na atrofia e absorção de proteínas.
- Estudos adequadamente elaborado para avaliar a intervenção nutricional em pacientes com DII sarcopênica.
Não existe uma “dieta oral para DII” que possa ser geralmente recomendada para promover a remissão em pacientes com doença ativa.2
Dietas experimentais, como carboidratos específicos, paleolíticos, sem glúten, oligo-, di- e monossacarídeos e polióis de baixa fermentação (FODMAP), dieta anti-inflamatória, dieta sem carragenina, dieta sem leite, dieta pobre ou rica em carne vermelha, dieta vegetariana e dietas enriquecidas com n-3 PUFA na inflamação intestinal ou na indução de remissão ainda precisam de mais estudos. Portanto, nenhuma “dieta oral para DII” pode ser geralmente recomendada para promover a remissão em pacientes com DII com doença ativa.
Esta recomendação não exclui a necessidade de todos os pacientes com DII receberem uma abordagem individual (nutricional) com base em sua situação pessoal específica, preferencialmente com a participação ativa de um nutricionista ou nutricionista dedicado como parte da abordagem multidisciplinar.2
A Dieta de Exclusão para Doença de Crohn (DEDC) associada a Nutrição Enteral Parcial com Modulen (NEP) deve ser considerada como uma alternativa à NE exclusiva em pacientes pediátricos e adultos com DC leve a moderada para alcançar a remissão.
A DEDC com NEP com Modulen® foi mais eficaz do que sem NEP Modulen® para indução e manuten- ção da remissão em adultos com DC virgem biológica leve a moderada e pode levar à remissão endoscó- pica. Esses dados sugerem que uma DEDC pode ser usada para DC ativa leve a moderada e deve ser avaliada em um estudo controlado randomizado avançado.2 Os probióticos não devem ser recomenda- dos para o tratamento da DC, nem para o tratamento da doença ativa, nem para a prevenção de recidivas na fase de remissão ou recorrência pós-operatória da doença. Na bolsite, probióticos multiespécies podem ser considerados para preveni-la.2
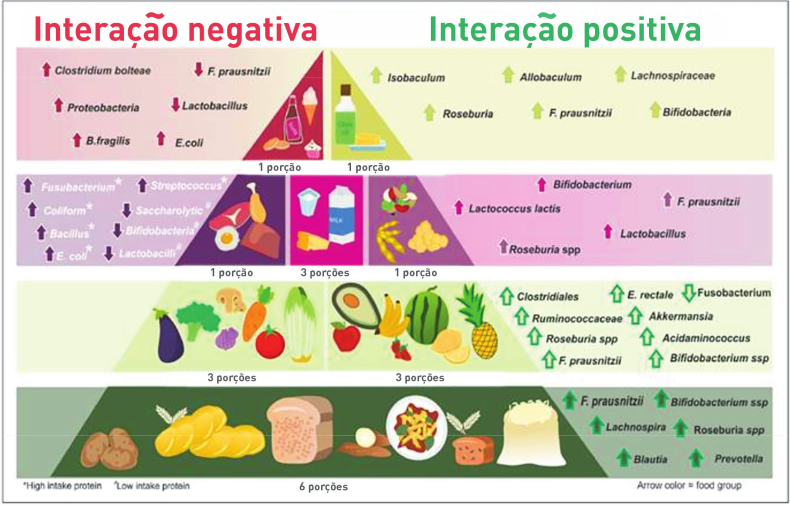
A pirâmide alimentar é uma ferramenta pré-estabelecida de educação nutricional. A integração entre microbioma intestinal, grupos de alimentos e bactérias produtoras de ácidos graxos de cadeia curta (AGCC), que se beneficiam da ingestão de carboidratos fermentáveis, tem o potencial de melhorar e inovar ainda mais a proposta de alimentação saudável. O conceito dieta-microbiota intestinal pode ser incorporado à ciência da nutrição, e a pirâmide alimentar pode auxiliar nessa interação nutricional. Diante desse contexto, Magro et al. propõem, por meio da pirâmide alimentar, a ampliação do conheci- mento entre a microbiota intestinal, grupos alimentares e bactérias produtoras de AGCC.13
Referências
Referências bibliográficas
1. Quaresma AB, et al. Temporal trends in the epidemiology of inflammatory bowel diseases in
the public healthcare in Brazil. The Lancet Regional Health – Americas. 2022;13: 100298
2. S.C. Bischoff, P. Bager, J. Escher et al. ESPEN guideline on Clinical Nutrition in
inflammatory bowel
disease. Clinical Nutrition. 2023; 42:352-379
3. Levine A, et al. Dietary Guidance From the International Organization for the Study of
Inflammatory
Bowel
Diseases. Clinical Gastroenterology and Hepatology 2020; 18:1381–1392
4. Day AS, et al. Food avoidance, restrictive eating behaviour and association with quality of
life in
adults
with inflammatory bowel disease: A systematic scoping review. Appetite. 2021; 167: 105650
5. Zallot C, et al. Dietary Beliefs and Behavior Among Inflammatory Bowel Disease Patients.
Inflamm Bowel
Dis.
2013; 19:66–72
6. Lopes EW, et al. Dietary Gluten Intake Is Not Associated With Risk of Inflammatory Bowel
Disease in US
Adults Without Celiac Disease. Clinical Gastroenterolo- gy and Hepatology. 2022; 20:303–313
7. Szilagyi A, et al. Systematic review and meta-analysis of lactose digestion, its impact on
intolerance
and
nutritional effects of dairy food restriction in inflamma- tory bowel diseases. Nutrition Journal. 2016;
15:67
8. Bolte LA, et al. Long-term dietary patterns are associated with proinflammatory and
anti-inflammatory
features of the gut microbiome. Gut 2021; 70:1287–1298
9. Dominguez LJ et al. Impact of Mediterranean Diet on Chronic Non-Communicable Diseases and
Longevity.
Nutrients. 2021, 13:2028
10. ESPEN consensus recommendation on use of CDED + PEN. Presented at 44th ESPEN Congress;
Vienna 3-6
September
2022.
11. Sigall Boneh R, Sarbagili Shabat C, Yanai H, et al. Dietary Therapy With the Crohn's
Disease Exclusion
Diet
is a Successful Strategy for Induction of Remission in Children and Adults Failing Biological Therapy. J
Crohns
Colitis. 2017;11(10):1205-1212.
12. Gerasimidis K, et al. Current recommendations on the role of diet in the aetiology and
management of
IBD.
Frontline Gastroenterology. 2022; 13:160–167.
13. Fatani H, et al. Systematic review of sarcopenia in inflammatory bowel disease. Clinical
Nutrition.
2013;
42: 1276-1291.
14. Magro DO, et al. Interaction between food pyramid and gut microbiota. A new nutritional
approach. Arq
Gastroenterol. 2023; 60:132-136.
Confira o Highlight comentado sobre o Pré Congresso de Nutrição pela Nutricionista Izabel Lamounier - Mestre em Nutrição Experimental pela USP, Especialista em Nutrição Enteral e Parenteral (BRASPEN), Nutricionista ABCD e Membro GEDIIB.
Faça o Login ou Cadastre-se para ver todos os conteúdos exclusivos