Do período de suspeita até o diagnóstico, pode levar muito tempo. O indivíduo demora a suspeitar que tenha um tumor e muitas das vezes, ele não associará os sintomas que está tendo com isso. É durante esse período que ele emagrece e acaba sofrendo o cataclismo inflamatório que o câncer pode gerar.
O diagnóstico é primeiramente histológico, sendo necessária uma biópsia. Mas também envolve o estadiamento. O estadiamento significa saber onde o tumor está localizado, bem como seu avanço ou se é metastático.
Estima-se que cerca de 40% a 80% dos pacientes apresentarão desnutrição durante o curso da doença¹, de 15% a 40% dos pacientes apresentam perda de peso até o diagnóstico² e 42% dos pacientes desnutridos intrahospitalares não recebem tratamento para tal.³
Como diagnosticar a desnutrição?
Avaliação Nutricional (AN)
Diversas ferramentas de triagem e avaliação nutricional baseiam-se em peso, altura, necessidades metabólicas e ingestão calórica; raramente são feitas em consultórios. Quando o paciente desenvolve alguma alteração nutricional indicada por esses parâmetros, isso já pode caracterizar a presença de sarcopênia.
Sarcopenia e prognóstico
Sarcopenia é uma síndrome geriátrica que acomete a musculatura esquelética de forma progressiva e generalizada. É a combinação do comprometimento da força, massa e performance muscular. No idoso, a presença de sarcopenia está associada a maior chance de desfechos negativos, tais como: quedas, fraturas, incapacidade física e mortalidade.4,5
Impacto da Sarcopenia no desfecho
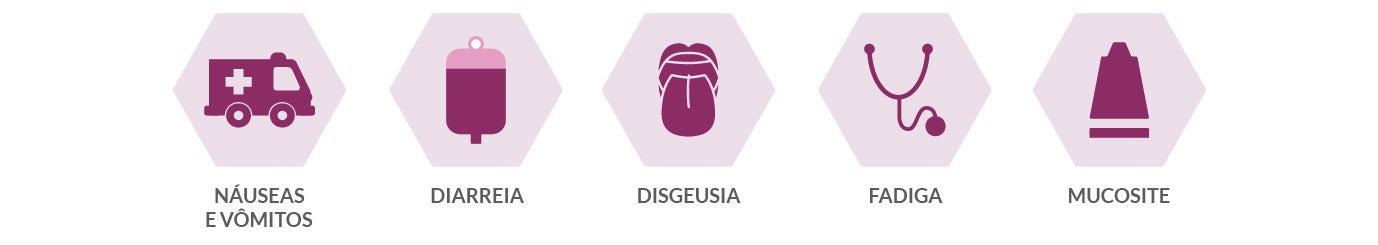
Menor tolerância ao tratamento
Os pacientes com sarcopenia que perdem peso principalmente durante o tratamento, não toleram bem o tratamento oncológico. A relação da dose de quimioterapia tem a ver com o desfecho. Os que conseguem tomar as doses adequadas são os pacientes que possuem melhor prognóstico, mas também possuem relação direta com a sarcopenia propriamente dita.6
Sobrevida menor
A perda muscular durante o tratamento implica em falha mais rápida e menor sobrevida global.7
Intervenção nutricional
Não há um remédio específico para a Sarcopenia. O que se tem é uma intervenção nutricional oral, dando suporte com suplementos orais, ou por meio de uma nutrição parenteral ou enteral. Consequentemente se vê um ganho de sobrevida com essas intervenções. Um paciente bem nutrido ou que não perde peso durante a quimioterapia tolera melhor o tratamento.
Exercícios físicos
Quanto mais o paciente está ativo, maior sobrevida ele tem com o tratamento. Pacientes ativos têm menos toxicidade com o tratamento.8

Caqueixa
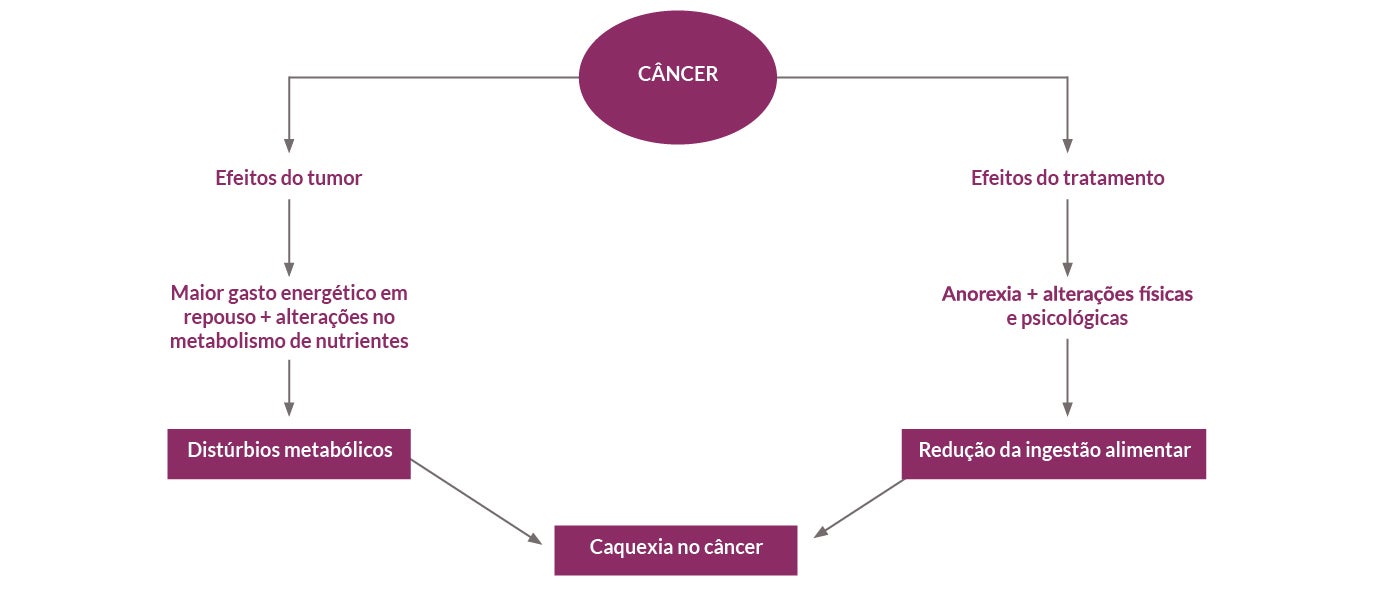
A caquexia associada ao câncer é uma síndrome multifatorial. É caracterizada por perda progressiva da massa muscular esquelética, acompanhada ou não da perda de gordura, não podendo ser totalmente revertida pela terapia nutricional convencional, levando a uma alteração funcional progressiva.9,10Ela afeta de 50% a 80% dos pacientes com câncer. Cerca de 20% das mortes de pacientes oncológicos estão relacionadas com a caquexia.11
Caqueixa associada ao câncer
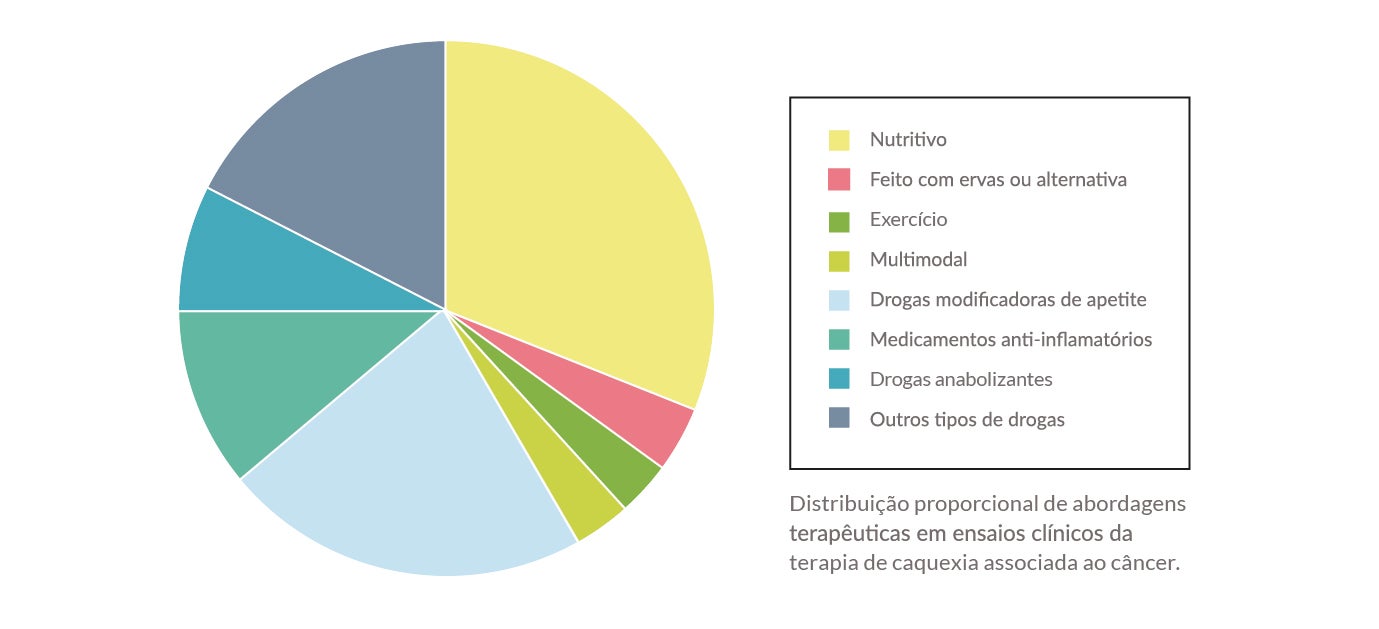
Abordagem terapêutica 13
Repercurssões indejáveis do câncer sobre o estado nutricional
O estado nutricional comprometido deve ser tratado desde o início e durante toda a jornada oncológica do paciente.14 É preciso nutrir o paciente em todas as frentes, seja na cirurgia, na quimioterapia ou radioterapia, porque esse estado nutricional prejudicado, essa perda de peso e de massa muscular, está relacionado a:15
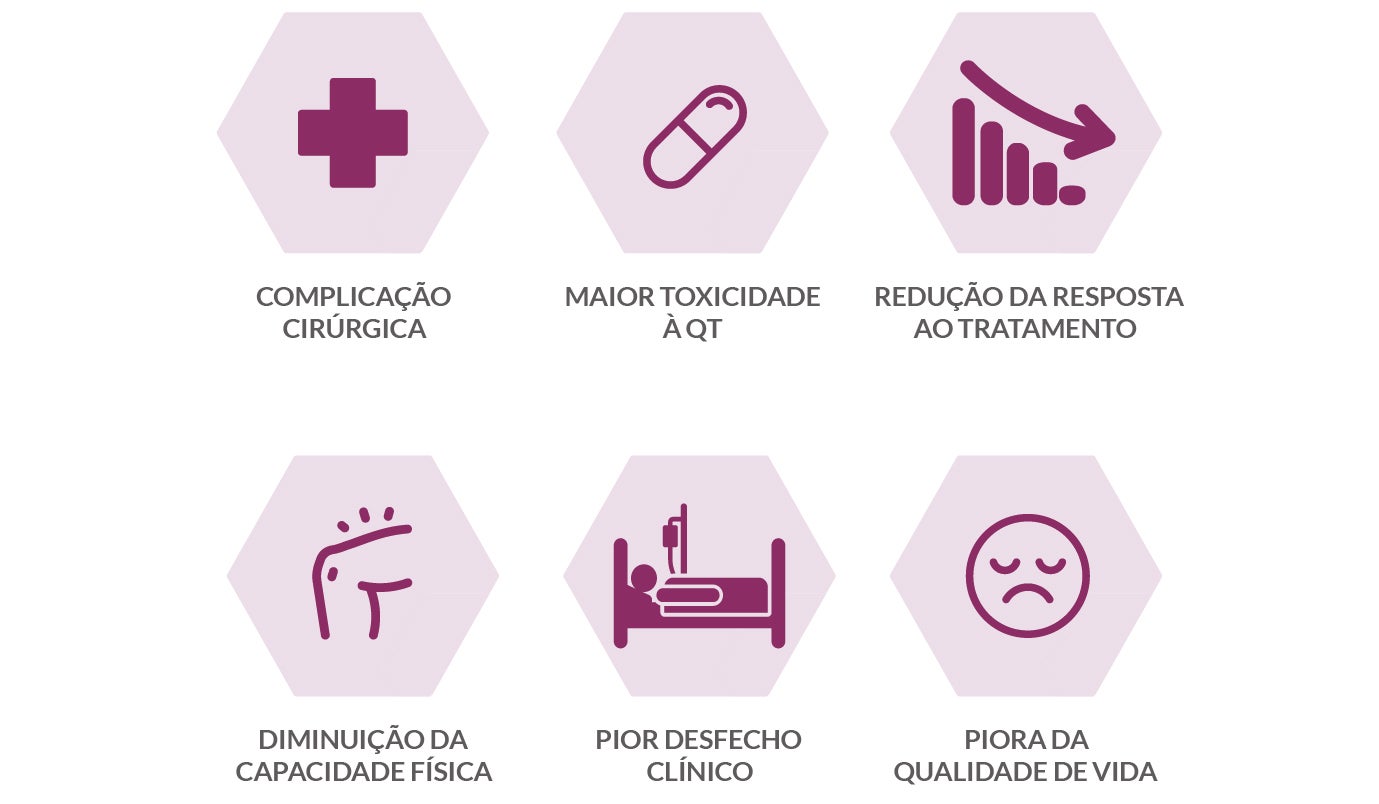
Manejo nutricional
O manejo nutricional tem como objetivo prevenir a perda de peso e da massa muscular, além de evitar interrupções do tratamento. Em cânceres com estágios mais avançados:16
- Melhora a qualidade de vida;
- Minimiza sintomas, como náuseas e vômitos que impactam na ingestão alimentar.
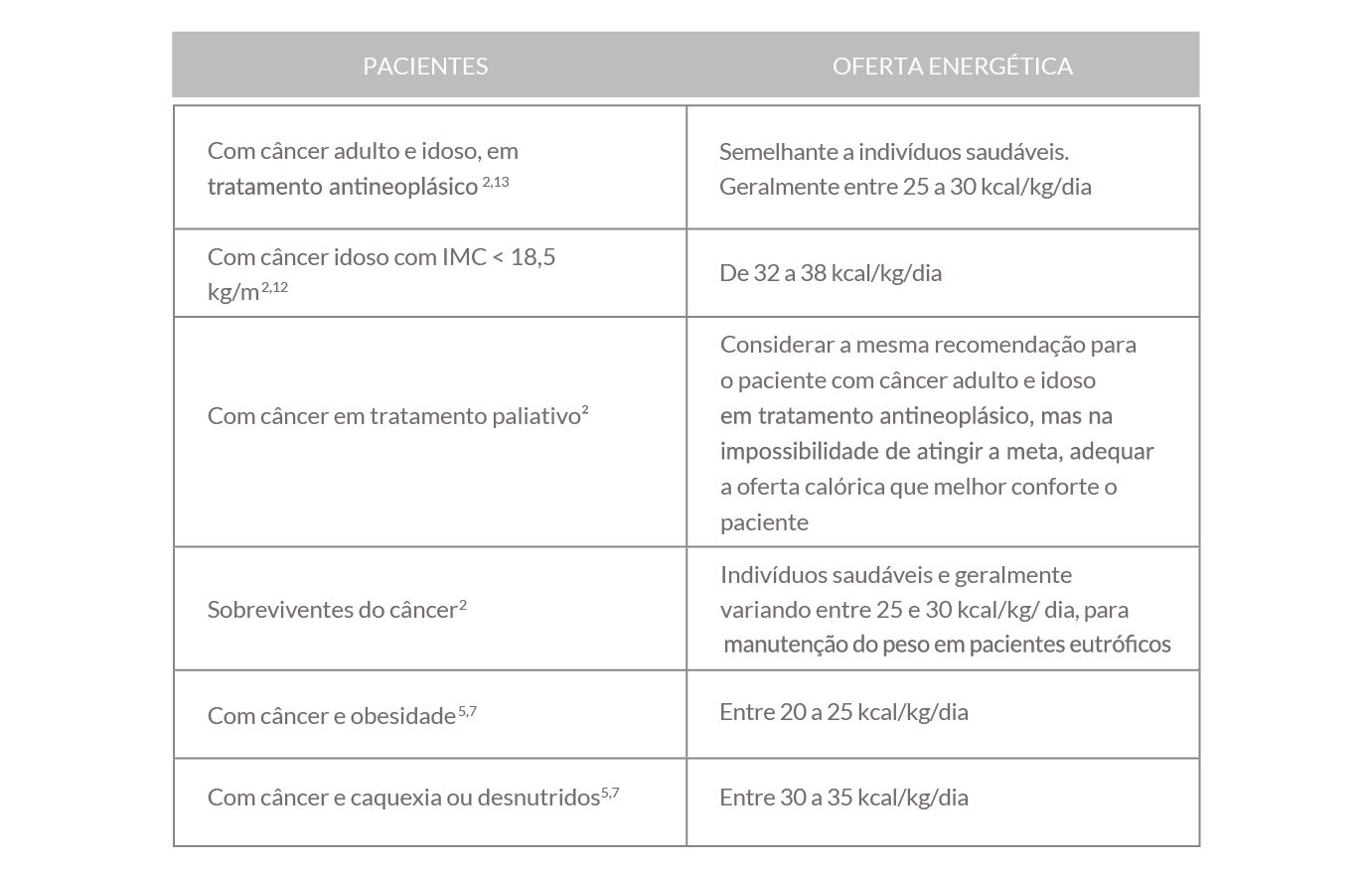
Necessidades calóricas
Como fazer intervenção nutricional para esse paciente, após a triagem e avaliação nutricional? É preciso realizar o cálculo das necessidades calóricas.
O que dizem as diretrizes?17
Tabela 2: Recomendações da oferta energética para paciente com câncer
Necessidades proteicas
ESPEN18,19
- Recomendado: > 1,0g/kg/dia
- Manter: 1,2 a 2,0g/kg/dia
- Se possível 1,5 g/kg/dia
- Cirurgia: 1,5g/kg Peso Ideal/dia
INCA20
- Tratamento oncológico sem complicações: de 1,0 a 1,2 g/kg/dia
- Tratamento oncológico com estresse moderado: de 1,2 a 1,5 g/kg/dia
- Tratamento oncológico com estresse grave e depleção proteica 1,5 a 2,0g/kg/dia
- Pacientes com algum grau de desnutrição, de 1,2 a 1,5g/kg/dia
- Operatórios.21
BRASPEN17
Considerar oferta proteica acima de 1,0 e, se a inflamação sistêmica for presente, considerar 1,2 -2,0g/Kg/dia pacientes com algum grau de desnutrição, de 1,2 a 1,5g/Kg/dia
O estado nutricional é um dos fatores que mais influenciam nos resultados do pós-operatório. A resposta orgânica ao trauma cirúrgico tem maiores repercussões e influencia negativamente os resultados pós operatórios.21
Manejo nutricional do paciente oncológico cirúrgico22,23
O paciente deve ter um cuidado integral, desde o pré-operatório até a alta hospitalar.
Benefícios do preparo imunológico
Atender o paciente antes da cirurgia oferece inúmeros benefícios. O uso de nutrientes imunomoduladores visa uma melhor resposta metabólica ao estresse, além de:
- Diminuição no tempo de permanência hospitalar (custos hospitalares);
- Melhora da cicatrização operatória;
- Melhora de marcadores bioquímicos como pré-albumina, proteína ligadora do retinol e trasferrina:
- Diminuição de taxas de infecções pós-cirurgicas:
- Manutenção da barreira intestinal como órgão de defesa.
Imunidade intestinal 22
Cerca de 80% do sistema imunológico está localizado no TGI. Portanto, através da alimentação saudável, nutrição enteral ou suplemento oral, se tem uma ótima maneira de modulá-lo.Terapia nuricional em cirurgia, em qual momento? 23
Recomenda-se que os pacientes cirúrgicos, independente do estado nutricional, recebem fórmulas imunomoduladoras contendo arginia, ômega-3, nucleotídeos e antioxidantes na quantidade de 500ml a 1000ml por dia, de 5 a 7 dias no pré-operátorio, sendo que para pacientes com alto risco nutricional, essa fórmula deve ser continuada no pós-operatório de 5 a 7 dias.
Conclusão

Todas as dúvidas dos pacientes devem ser desmistificadas, sendo necessária a devida orientação sobre o tratamento nutricional, da melhor forma possível.
Referências bibliográficas
Referências 1. Dewys WD, et al. Prognostic Effect of Weight Loss Prior to Chemotherapy in Cancer Patients. Eastern Cooperative Oncology Group. Am J. Med. 1980;69(4):481-97.2. Wigmore SJ, et al. Contribution of anorexia and hypermetabolism to weight loss in anicteric patients with pancreatic cancer. BJS. 1997;84(2):196-7. 3. Hébuterne X, et al. Prevalence of Malnutrition and Current Use of Nutrition Support in Patients With Cancer. JPEN. 2014;38(2):196-204. 4. Colloca G, et al. Muscoloskeletal aging, sarcopenia and cancer. J Geriatr Oncol. 2019;10(3):504-509. 5. Ryan AM, et al. Cancer-associated malnutrition, cachexia and sarcopenia: the skeleton in the hospital closet 40 years later. Proc Nutr Soc. 2016;75(2):199-211. 6. Ganju RG, et al. The impact of skeletal muscle abnormalities on tolerance to adjuvant chemotherapy and radiation and outcome in patients with endometrial cancer. J Med Imaging Radiat Oncol. 2019;64(1):104-12. 7. Sugiyama K, et al. Baseline Sarcopenia and Skeletal Muscle Loss During Chemotherapy Affect Survival Outcomes in Metastatic Gastric Cancer. Anticancer Res. 2018;38(10):5859-66. 8. Guercio BJ, et al. Associations of Physical Activity With Survival and Progression in Metastatic Colorectal Cancer: Results From Cancer and Leukemia Group B (Alliance)/SWOG 80405. Journal of Clinical Oncology. 2019;37(29):2620-31. 9. cachexia: an international consensus. Lancet Oncol. 2011;12(5):489-95. 10. Ryan AM, et al. Cancer-associated malnutrition, cachexia and sarcopenia: the skeleton in the hospital closet 40 years later. Proc Nutr Soc. 2016;75(2):199-211. 11. Argilés JM, et al. Cancer Cachexia: Understanding the Molecular Basis. Nat Ver Cancer. 2014;14(11):754-62. 12. Van Cutsem E, Arends J. The Causes and Consequences of Cancer-Associated Malnutrition. Eur J Oncol Nurs. 2005;9(Suppl 2):51-63. 13. Baracos VE, et al. Cancer-associated cachexia. Nat Rev Dis Primers. 2018;4:17105. 14. Britton B, et al. Eating As Treatment (EAT) study protocol. BMJ Open. 2015;5(7):e008921. 15. 16. Blackwood HA, et al. A Systematic Review Examining Nutrition Support Interventions in Patients With Incurable Cancer. Support Care Cancer. 2020;28(4):1877-1889. 17. Horie LM, et al. Diretriz BRASPEN de terapia nutricional no paciente com câncer. BRASPEN J. 2019;34(1):3-23. 18. Arends J, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr. 2017;36(1):11_48. 19. Weimann A, et al. ESPEN guideline: Clinical nutrition in surgery. Clin Nutr. 2017;36(3):623-50. 20. Consenso nacional de nutrição oncológica / Instituto Nacional de Câncer José Alencar Gomes da Silva, Coordenação Geral de Gestão Assistencial, Hospital do Câncer I, Serviço de Nutrição e Dietética; organização Nivaldo Barroso de Pinho - 2. ed. rev ampl atual - Rio de Janeiro: INCA, 2015; 182p. 21. Koch CG, et al. What Are the Real Rates of Postoperative Complications: Elucidating Inconsistencies Between Administrative and Clinical Data Sources. J Am Coll Surg. 2012;214(5):798-805. 22. Bengmark S. Enteral nutrition in HPB surgery: past and future. Journal of Hepato-Billary-Pancreatic Surgery. 2002;9(4):448-458. 23. McClave AS, et al. An Evidence-Based Approach to Perioperative Nutrition Support in the Elective Surgery Patient. JPEN. 2013;37(5 Suppl) :39S-50S.
NHS000126 - Material destinado exclusivamente a profissionais da saúde. Proibida a distribuição aos consumidores.
Faça o Login ou Cadastre-se para ver todos os conteúdos exclusivos