Nutrição celular no envelhecimento - Como aplicar?
Dra. Ana Beatriz Galhardi Di Tommaso
Todos já estamos cansados de ouvir falar que o Brasil e o mundo estão envelhecendo, mas será que de fato paramos para pensar na importância e no impacto desta informação? Talvez muitos especialistas sejam capazes de avaliar os desfechos e desenhar estratégias de cuidados, porém, uma pergunta ainda persiste: será que todos são capazes de enxergar que os idosos do futuro seremos nós mesmos? A verdade é que falar de envelhecimento é pensar e refletir sobre nosso próprio futuro, um futuro que chegará rapidamente à nossa realidade sem que tenhamos tempo para prepará-lo da forma que consideramos ideal.
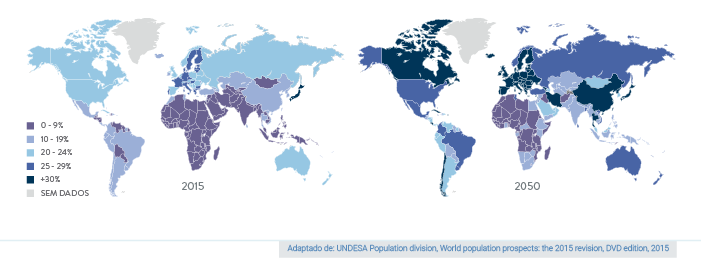
A taxa de envelhecimento no Brasil e na América Latina se mostra incrivelmente rápida e assustadora:
- Em cerca de 40 anos, teremos aproximadamente 30% da população composta por idosos, número semelhante à Europa atualmente
- Um detalhe, no entanto, é bastante relevante: a França, por exemplo, atingiu esse patamar ao longo de 150 anos e nós iremos ter menos tempo para nos preparar.
A compreensão e abordagem do envelhecimento de forma mais ampla torna-se mandatória. O primeiro grande conceito que devemos sempre lembrar é que velhice por si só não é uma causa de morte e ter mais de 60 anos não é sinônimo de estar doente.
Dentro desse tópico ainda há uma grande diferença entre senescência e senilidade:
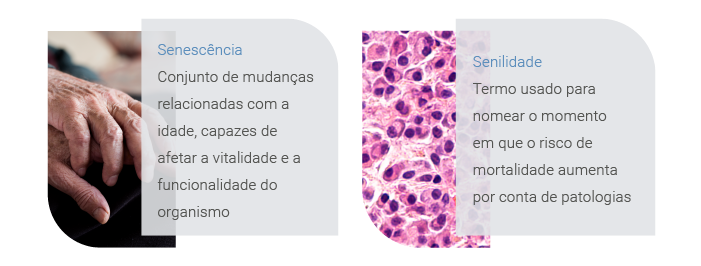
Fica claro que há etapas do envelhecimento que são comuns para todos os seres humanos, mas quando o passar dos anos vêm acompanhado de doenças e dependência, estamos diante de um envelhecimento longe do ideal.
Afinal, quando começamos de fato, a envelhecer?
Cada parte do nosso organismo carrega suas particularidades, mas pode-se dizer que por volta dos 30 a 40 anos.2 Isso por que muitos de nossos órgãos e sistemas passam a ter suas reservas e seus mecanismos de defesa diminuídos.
A promoção da saúde para o envelhecimento DEVE começar muito antes dos 60 anos
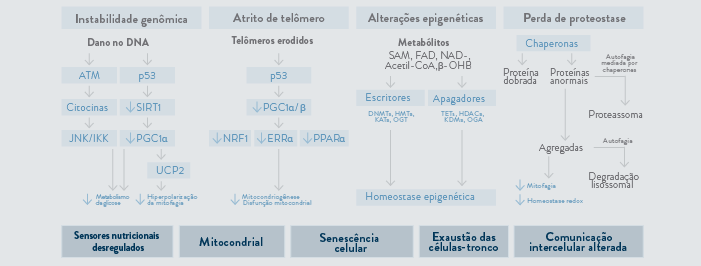
Existem diversas teorias que estudam e tentam explicar os motivos do envelhecimento. Atualmente, sabe-se que as mudanças de estrutura e função dependentes da idade que promovem o envelhecimento malsucedido são:
Se existe um padrão, talvez ele possa ser ajustado ou modificado. As teorias carregam em si o mesmo questionamento: qual seria a chave para impedir disfunções e doenças? Quais são os fatores que promovem longevidade com saúde? Precisaríamos de semanas, meses ou até mesmo anos para detalhar cada uma das hipóteses da ciência. Algumas teorias são baseadas em órgãos e sistemas, outras são fundamentadas em bases fisiológicas e genômicas. Alguns acreditam que todas as alterações seriam secundárias a erros intrínsecos do DNA, outros, acreditam que o meio externo é o grande fator responsável por doenças. Abaixo apresentamos algumas das teorias existentes.3
Figura 1. O impacto metabólico dos marcadores de longevidade.
Alguns estudos reforçam o papel da alimentação balanceada e sem excessos e a atividade física como os dois grandes promotores de saúde da nossa espécie.4, 5 O papel da dieta e do exercício físico na manutenção da saúde e ganho de qualidade de vida é indiscutível e inegável. O grande problema é que muitas vezes as pessoas são sensibilizadas a adotar hábitos de vida mais saudáveis quando estão na iminência de desenvolver uma doença crônica ou quando o diagnóstico já está fechado. Identificar e prevenir complicações de doenças já instaladas é fundamental, porém, será suficiente? Talvez não. Precisamos entender de fato os mecanismos anteriores a essas e outras disfunções, para prevenir a instalação de complicadores de saúde.
Como a ciência poderia nos ajudar?
Como mostrado, dentre as “teorias” existentes sobre o impacto metabólico dos marcadores de longevidade, a nutrição celular está entre elas. A chave para entendermos os mecanismos relacionados ao envelhecimento parece estar na melhor compreensão da respiração celular e de seus subprodutos.
Aminoácidos, estresse oxidativo e envelhecimento
O oxigênio (O2>) é essencial à vida, sendo que humanos são dependentes de oxigênio em diferentes reações de oxidação, por exemplo, na via de síntese de adenosina trifosfato (ATP). Contudo, quando o oxigênio atua como aceptor de elétrons, há a possibilidade de formação de espécies reativas de oxigênio (altamente reativas), que podem provocar lesões em estruturas celulares, incluindo carboidratos, lipídios, proteínas e o ácido desoxirribonucleico (DNA). Dentre as espécies reativas de oxigênio formadas pela redução do oxigênio destacam-se: O radical superóxido (O2-), o peróxido de hidrogênio (H2)e o radical hidroxila (OH•). Dentre as espécies reativas de nitrogênio, as quais contêm nitrogênio e oxigênio, destaca-se: O óxido nítrico (NO).1, 4
No que refere-se à lesão celular mediada por espécies reativas de oxigênio, verifica-se que o superóxido e o radical hidroxila promovem peroxidação lipídica nas membranas celular, mitocondrial, nuclear e do retículo endoplasmático. Tais fatos estão associados ao aumento da permeabilidade celular, podendo promover lesão mitocondrial. Além disso, o DNA mitocondrial e nuclear podem ser oxidados, resultando em rompimentos de determinados pontos ao longo da fita de DNA.5, 6
O estresse oxidativo ocorre quando a taxa de produção de espécies reativas de oxigênio e de nitrogênio supera a capacidade de remoção por meio de mecanismo de defesa celular, os quais incluem diferentes enzimas antioxidantes, antioxidantes endógenos e exógenos, compartimentalização celular, sequestro de metais e sistema de reparo de componentes celulares lesados. No sistema de defesa enzimático, a enzima superóxido dismutase (SOD) remove o radical superóxido, enquanto as enzimas catalase e glutationa peroxidase removem o peróxido de hidrogênio e os peróxidos lipídicos.7, 8
A conversão do O2- para H2O2 e oxigênio catalisada pela enzima SOD é frequentemente a primeira defesa contra o estresse oxidativo. A enzima glutationa peroxidase (GPx) — a qual apresenta selênio na sua estrutura, na forma do aminoácido selenocisteína — reduz o H2O2 para água, em cuja reação há transferência de elétrons a partir da glutationa reduzida (GSH) para o H²O². Estes mecanismos estão descritos visualmente na figura 2.3, 4, 7, 9
Figura 2. Reações que envolvem as enzimas antioxidantes superóxido dismutase (SOD) e glutationa peroxidase (GPx).
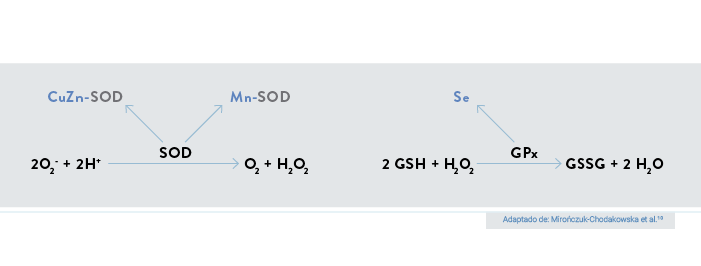
A GSH é um tripeptídeo (gama-glutamilcisteinilglicina) composto pelos aminoácidos glutamato, cisteína e glicina, e representa o principal antioxidante celular em situações de estresse oxidativo. Em reações catalisadas pela GPx, duas moléculas de GSH são oxidadas para formar uma molécula de glutationa oxidada (GSSG). Uma vez formada, a GSSG pode ser reconvertida para a forma reduzida (GSH) por meio de reação catalisada pela enzima glutationa redutase (GR) (figura 3). Cabe destacar que a GSH apresenta a capacidade de regenerar moléculas oxidadas com ação antioxidante, por exemplo, as vitaminas C e E.9, 11
Figura 3. Etapas envolvidas na síntese intracelular de glutationa (GSH).

Em relação aos três aminoácidos que compõem a GSH, cabe destacar que o glutamato é designado como um aminoácido dispensável, uma vez que pode ser sintetizado no organismo a partir de outros aminoácidos, enquanto a cisteína e a glicina são designados aminoácidos condicionalmente indispensáveis, uma vez que são sintetizados a partir de outros aminoácidos e/ou sua síntese é limitada em determinadas condições clínicas.5
O envelhecimento pode estar associado à:13, 17
Nesse contexto, Sekhar et al.¹⁸ verificaram que indivíduos idosos (60-75 anos) apresentaram menor concentração eritrocitária de cisteína, de glicina e de GSH em comparação a indivíduos adultos jovens. Além disso, idosos apresentaram menor capacidade de síntese absoluta de GSH eritrocitária e maior concentração plasmática de biomarcadores de estresse oxidativo. Todavia, a suplementação com aminoácidos precursores de GSH em idosos, promoveu aumento de 95% da concentração de GSH e de 231% da capacidade de síntese absoluta de GSH em eritrócitos, bem como reduziu a concentração de biomarcadores de estresse oxidativo. Cabe destacar que, após o período de intervenção nutricional, os valores referentes aos parâmetros supracitados em idosos suplementados com cisteína e glicina não diferiram em relação àqueles observados em adultos jovens. Esses resultados indicam que a deficiência de GSH em idosos ocorre, em maior parte, devido à redução do fornecimento dos precursores de GSH — glicina e cisteína — preferivelmente à diminuição da capacidade de síntese intracelular de GSH.
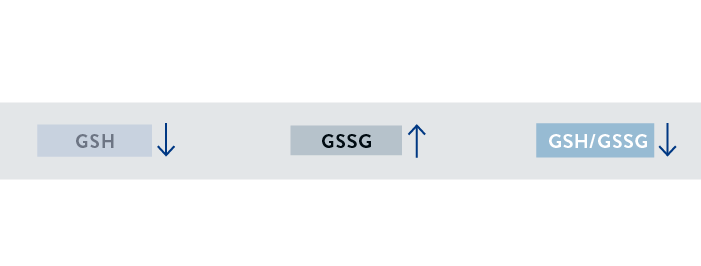
A hiperglicemia está relacionada ao estresse oxidativo devido ao aumento da produção de espécies reativas de oxigênio. Nesse sentido, Sekhar et al.19 verificaram que indivíduos com diabetes tipo 2 (51 ± 3 anos) não controlado apresentaram menor concentração eritrocitária de glicina, de cisteína e de GSH e menor razão GSH/GSSG quando comparados ao grupo controle composto por indivíduos não diabéticos (50 ± 4 anos). Não obstante, indivíduos diabéticos suplementados com cisteína e glicina, apresentaram aumento da concentração e da síntese eritrocitária de GSH e redução da concentração de biomarcadores de estresse oxidativo. Esse estudo indica que pacientes com diabetes tipo 2 não controlado apresentam deficiência de síntese de GSH devido à limitada disponibilidade de aminoácidos precursores, enquanto a suplementação com cisteína e glicina restaura a síntese intracelular de GSH e reduz o estresse oxidativo.
Em outro estudo envolvendo idosos suplementados com cisteína e glicina, foi verificado o aumento da capacidade de oxidação de ácidos graxos não esterificados, bem como redução da resistência à ação da insulina, cujos fatos evidenciam efeito metabólico positivo relacionado ao aumento da capacidade de síntese de GSH.20.
Em suma, a partir dos resultados observados nos estudos supracitados, constata-se que a suplementação com cisteína e glicina pode representar estratégia nutricional efetiva, visando aumento da síntese intracelular de GSH e consequente redução do estresse oxidativo associado ao envelhecimento.
Além disso, vale reforçar que outros nutrientes podem ter papel importante e de cofatores para auxiliar no funcionamento de todo esse metabolismo, como vitaminas C e E, zinco e selênio.
Referências bibliográficas
(Aminoácidos, Estresse Oxidativo e Envelhecimento)
1. Birben E, Sahiner UM, Sackesen C, Erzurum S, Kalayci O. Oxidative stress and antioxidant defense. World Allergy Organ J 2012;5(1):9–19.
2. Csányi G, Miller Jr. FJ. Oxidative stress in cardiovascular disease. Int J Mol Sci 2014;15:6002–8.
3. Lü JM, Lin PH, Yao Q, Chen Ch. Chemical and molecular mechanisms of antioxidants: experimental approaches and model systems. J Cell Mol Med 2010;14(4):840–60.
4. Weidinger A, Kozlov AV. Biological activities of reactive oxygen and nitrogen species: oxidative stress versus signal transduction. Biomolecules 2015;5 (2):472–84.
5. López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013;153(6):1194-217.
6. López-Otín C, Galluzzi L, Freije JMP, Madeo F, Kroemer G. Metabolic Control of Longevity. Cell. 2016;166(4):802-821.
7. Moylan JS, Reid MB (2007). Oxidative stress, chronic disease, and muscle wasting. Muscle Nerve 35, 411–429.
8. Muftuoglu M, Mori MP, de Souza-Pinto NC. Formation and repair of oxidative damage in the mitochondrial DNA. Mitochondrion 2014;17:164–81.
9. Mirończuk- -Chodakowska I, Witkowska AM, Zujko ME. Endogenous non-enzymatic antioxidants in the human body. Adv Med Sci. 2018;63(1):68-78.
10. Calabrese G, Morgan B, Riemer J. Mitochondrial Glutathione: Regulation and Functions. Antioxid Redox Signal. 2017;27(15):1162-1177.
11. Forman HJ, Zhang H, Rinna A. Glutathione: overview of its protective roles, measurement, and biosynthesis. Mol Aspects Med 2009;30(1-2):1–12.
12. Laidlaw SA, Kopple JD. Newer concepts of the indispensable amino acids. Am J Clin Nutr. 1987 Oct;46(4):593-605.
13. Erden-Inal M, Sunal E, Kanbak G. Age-related changes in the glutathione redox system. Cell Biochem Funct 2002;20:61–6.
14. Lang CA, Naryshkin S, Schneider DL, Mills BJ, Lindeman RD. Low blood glutathione levels in healthy aging adults. J Lab Clin Med 1992; 120:720–5.
15. Rebrin I, Sohal RS. Pro-oxidant shift in glutathione redox state during aging. Adv Drug Deliv Rev 2008;60:1545–52.
16. Samiec PS, Drews-Botsch C, Flagg EW, Kurtz JC, Sternberg P Jr, Reed RL, Jones DP. Glutathione in human plasma: decline in association with aging, age-related macular degeneration, and diabetes. Free Radic Biol Med 1998;24:699–704.
17. Sekhar RV, Liu CW, Rice S. Increasing glutathione concentrations with cysteine and glycine supplementation lowers inflammation in HIV patients. AIDS. 2015; 29(14):1899- -900.
18. Sekhar RV, Patel SG, Guthikonda AP, Reid M, Balasubramanyam A, Taffet GE, Jahoor F. Deficient synthesis of glutathione underlies oxidative stress in aging and can be corrected by dietary cysteine and glycine supplementation. Am J Clin Nutr. 2011; 94(3):847-53.
19. Sekhar RV, McKay SV, Patel SG, Guthikonda AP, Reddy VT, Balasubramanyam A, Jahoor F. Glutathione synthesis is diminished in patients with uncontrolled diabetes and restored by dietary supplementation with cysteine and glycine. Diabetes Care. 2011; 34(1):162-7.
20. Nguyen D, Samson SL, Reddy VT, Gonzalez EV, Sekhar RV. Impaired mitochondrial fatty acid oxidation and insulin resistance in aging: novel protective role of glutathione. Aging Cell. 2013;12(3):415-25.
Todos já estamos cansados de ouvir falar que o Brasil e o mundo estão envelhecendo, mas será que de fato paramos para pensar na importância e no impacto desta informação?
Faça o Login ou Cadastre-se para ver todos os conteúdos exclusivos